لماذا يغير اليود I2 لون النشا starch الى الأزرق؟ - منتديات تكنولوجيا الطحن
لماذا يغير اليود I2 لون النشا starch الى الأزرق؟
اختبار اليود Iodine test :
يعد استخدام اليود لاختبار احتواء العينة على النشا starch من الاختبارات العامة والمعروفة لدى الكيميائي. يتم هذا الاختبار بتحضير محلول من اليود (I2) ويوديد البوتاسيوم (KI) في الماء ويكون لون هذا المحلول بني (برتقالي غامق) وعند اضافة هذا المحلول الى عينة تحتوي على النشاء كالخبز مثلا فسيتحول اللون الى الأزرق الغامق. لكن كيف حدث هذا التغير في اللون؟!
النشا starch : عبارة عن مركب عضوي كاربوهيدراتي يحتوي على نوعين مختلفين من متعدد الساكاريد حيث يتكون من وحدات من الغلوكوز المرتبطة في ما بينها بطريقتين مختلفتين. الأولى هي الأميلوز وهو عبارة عن سلاسل خطية من الغلوكوز المرتبطة مع بعضها، و الثانية هي الأميلوبكتين المتفرع.
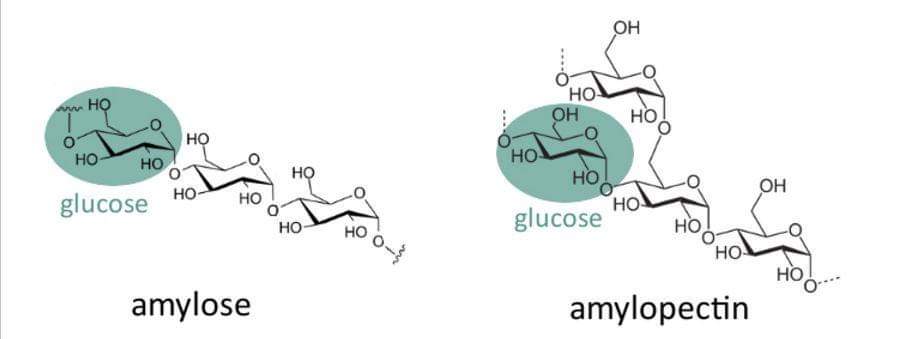
والأميلوز هو المركب المسؤول عن اللون الأزرق للنشاء عند اضافة اليود عليه. حيث تكون سلاسل الأميلوز حلزونية الشكل مما يسمح لليود بالارتباط والتموضع ضمن هذا الشكل الحلزوني.
المعقدات ذات الشحنة الغير متموضعة:
تصدر الألوان من المعقدات الحاوية على شحنات غير متموضعة (charge transfer complexes). يتم اضافة يوديد البوتاسيوم الى اليود الحر (I2) لأن الأخير غير ذواب في الماء (نسبياً) ولكن عند خلطه مع (KI) سيشكل شوارد اليود المتعدد مثل (In–) ، الشحنة السالبة في هذه الشوارد تلعب دور مانح للشحنة ويلعب اليود الحر كمستقبل لهذه الشحنة مما يؤدي الى انتقال الالكترون بين المانح والمستقبل وذلك عن طريق تحريضه بسهولة الى مستوى أعلى للطاقة بواسطة الضوء. فيمتص جزء من الضوء في هذه العملية ويظهر مكمل الضوء الممتص لعين المشاهد.
في حالة المحلول المائي لمتعدد اليود السابق ذكره، فإن اللون الذي يظهر هو اللون البني ولكن عند اضافة الأميلوز فسيتكون نوع آخر من المعقد ذو الشحنة الغير متموضعة. هنا يلعب الأميلوز كمانح للشحنة و متعدد اليود كمستقبل للشحنة. والمعقد النهائي يظهر لوناً مختلفاً عن متعدد اليود ويظهر باللون الأزرق الغامق.
سلاسل متعدد اليود:
لم يتم التأكد من شكل وتموضع متعدد اليود داخل حلزون الأميلوز نظراً لبنية معقد الأميلوز مع اليود الغير منتظمة (amorphous) (ليس بلوري) لكن تم اقتراح أن السلاسل المتموضعة داخل الشكل الحلزوني هي عبارة عن وحدات متكررة من الشوارد (I3–) و (I5–). حيث استطاع رام سيشادري (Ram Seshadri) وزملاؤه من جامعة كاليفورنيا اثبات أن سلاسل شوارد اليود تتموضع بشكل مرتب داخل الأميلوز. وذلك عن طريق اصطناع معقد مشابه للمعقد السابق ولكن ببنية منتظمة (بلورية) وهو معقد بيرولوبيريلين اليود كما أن له لون مشابه تماماً للون معقد اليود مع الأميلوز وبما أنه بلوري فقد استطاعوا دراسته بأشعة اكس لتبيان كيفية تموضع السلاسل ضمن الجزيء الحلزوني.
المصادر:
اختبار اليود Iodine test :
يعد استخدام اليود لاختبار احتواء العينة على النشا starch من الاختبارات العامة والمعروفة لدى الكيميائي. يتم هذا الاختبار بتحضير محلول من اليود (I2) ويوديد البوتاسيوم (KI) في الماء ويكون لون هذا المحلول بني (برتقالي غامق) وعند اضافة هذا المحلول الى عينة تحتوي على النشاء كالخبز مثلا فسيتحول اللون الى الأزرق الغامق. لكن كيف حدث هذا التغير في اللون؟!
النشا starch : عبارة عن مركب عضوي كاربوهيدراتي يحتوي على نوعين مختلفين من متعدد الساكاريد حيث يتكون من وحدات من الغلوكوز المرتبطة في ما بينها بطريقتين مختلفتين. الأولى هي الأميلوز وهو عبارة عن سلاسل خطية من الغلوكوز المرتبطة مع بعضها، و الثانية هي الأميلوبكتين المتفرع.

والأميلوز هو المركب المسؤول عن اللون الأزرق للنشاء عند اضافة اليود عليه. حيث تكون سلاسل الأميلوز حلزونية الشكل مما يسمح لليود بالارتباط والتموضع ضمن هذا الشكل الحلزوني.

المعقدات ذات الشحنة الغير متموضعة:
تصدر الألوان من المعقدات الحاوية على شحنات غير متموضعة (charge transfer complexes). يتم اضافة يوديد البوتاسيوم الى اليود الحر (I2) لأن الأخير غير ذواب في الماء (نسبياً) ولكن عند خلطه مع (KI) سيشكل شوارد اليود المتعدد مثل (In–) ، الشحنة السالبة في هذه الشوارد تلعب دور مانح للشحنة ويلعب اليود الحر كمستقبل لهذه الشحنة مما يؤدي الى انتقال الالكترون بين المانح والمستقبل وذلك عن طريق تحريضه بسهولة الى مستوى أعلى للطاقة بواسطة الضوء. فيمتص جزء من الضوء في هذه العملية ويظهر مكمل الضوء الممتص لعين المشاهد.
في حالة المحلول المائي لمتعدد اليود السابق ذكره، فإن اللون الذي يظهر هو اللون البني ولكن عند اضافة الأميلوز فسيتكون نوع آخر من المعقد ذو الشحنة الغير متموضعة. هنا يلعب الأميلوز كمانح للشحنة و متعدد اليود كمستقبل للشحنة. والمعقد النهائي يظهر لوناً مختلفاً عن متعدد اليود ويظهر باللون الأزرق الغامق.
سلاسل متعدد اليود:
لم يتم التأكد من شكل وتموضع متعدد اليود داخل حلزون الأميلوز نظراً لبنية معقد الأميلوز مع اليود الغير منتظمة (amorphous) (ليس بلوري) لكن تم اقتراح أن السلاسل المتموضعة داخل الشكل الحلزوني هي عبارة عن وحدات متكررة من الشوارد (I3–) و (I5–). حيث استطاع رام سيشادري (Ram Seshadri) وزملاؤه من جامعة كاليفورنيا اثبات أن سلاسل شوارد اليود تتموضع بشكل مرتب داخل الأميلوز. وذلك عن طريق اصطناع معقد مشابه للمعقد السابق ولكن ببنية منتظمة (بلورية) وهو معقد بيرولوبيريلين اليود كما أن له لون مشابه تماماً للون معقد اليود مع الأميلوز وبما أنه بلوري فقد استطاعوا دراسته بأشعة اكس لتبيان كيفية تموضع السلاسل ضمن الجزيء الحلزوني.
المصادر:
ChemistryViews.| (December 06, 2016).| Why Does Iodine Turn Starch Blue.| chemistry views. |From: http://www.chemistryviews.org/…/Why_Doe ... urn_Starch…
Infinite Polyiodide Chains in the Pyrroloperylene-Iodine Complex: Insights into the Starch-Iodine and Perylene-Iodine Complexes, Sheri Madhu, Hayden A. Evans, Vicky V. T. Doan-Nguyen, John G. Labram, Guang Wu, Michael L. Chabinyc, Ram Seshadri, Fred Wudl, Angew. Chem. Int. Ed. 2016, 55, 8032–8035. DOI: 10.1002/anie.201601585
Infinite Polyiodide Chains in the Pyrroloperylene-Iodine Complex: Insights into the Starch-Iodine and Perylene-Iodine Complexes, Sheri Madhu, Hayden A. Evans, Vicky V. T. Doan-Nguyen, John G. Labram, Guang Wu, Michael L. Chabinyc, Ram Seshadri, Fred Wudl, Angew. Chem. Int. Ed. 2016, 55, 8032–8035. DOI: 10.1002/anie.201601585
- الحصول على الرابط
- X
- بريد إلكتروني
- التطبيقات الأخرى
- الحصول على الرابط
- X
- بريد إلكتروني
- التطبيقات الأخرى
تعليقات
إرسال تعليق